Перевірка фейків у рамках партнерства з Facebook
Користувачі соцмереж поширюють дописи про те, що в Україні триває так званий «клінічний експеримент» — вакцинація від COVID-19. Наприклад, у Facebook поширюють відео, на якому закадровий жіночий голос розповідає, в яких офіційних документах це вказано. Авторка посилається на численні закони та підзаконні нормативно-правові акти. Однак вона хибно, на власний розсуд трактує всі офіційні документи, вириває з контексту окремі фрази, а також посилається на закони та постанови, які не мають нічого спільного з вакцинацією.
VoxCheck спростовує деякі неправдиві твердження з цього відео.
Хибна теза: у Державному реєстрі лікарських засобів препарати, які називаються вакцинами від COVID-19, не мають статусу вакцини. «Вакцини від COVID-19» — це торговельна назва. За документами це імунологічні препарати для екстреного використання.
Усі доступні в Україні вакцини зареєстровані та мають статус вакцини.
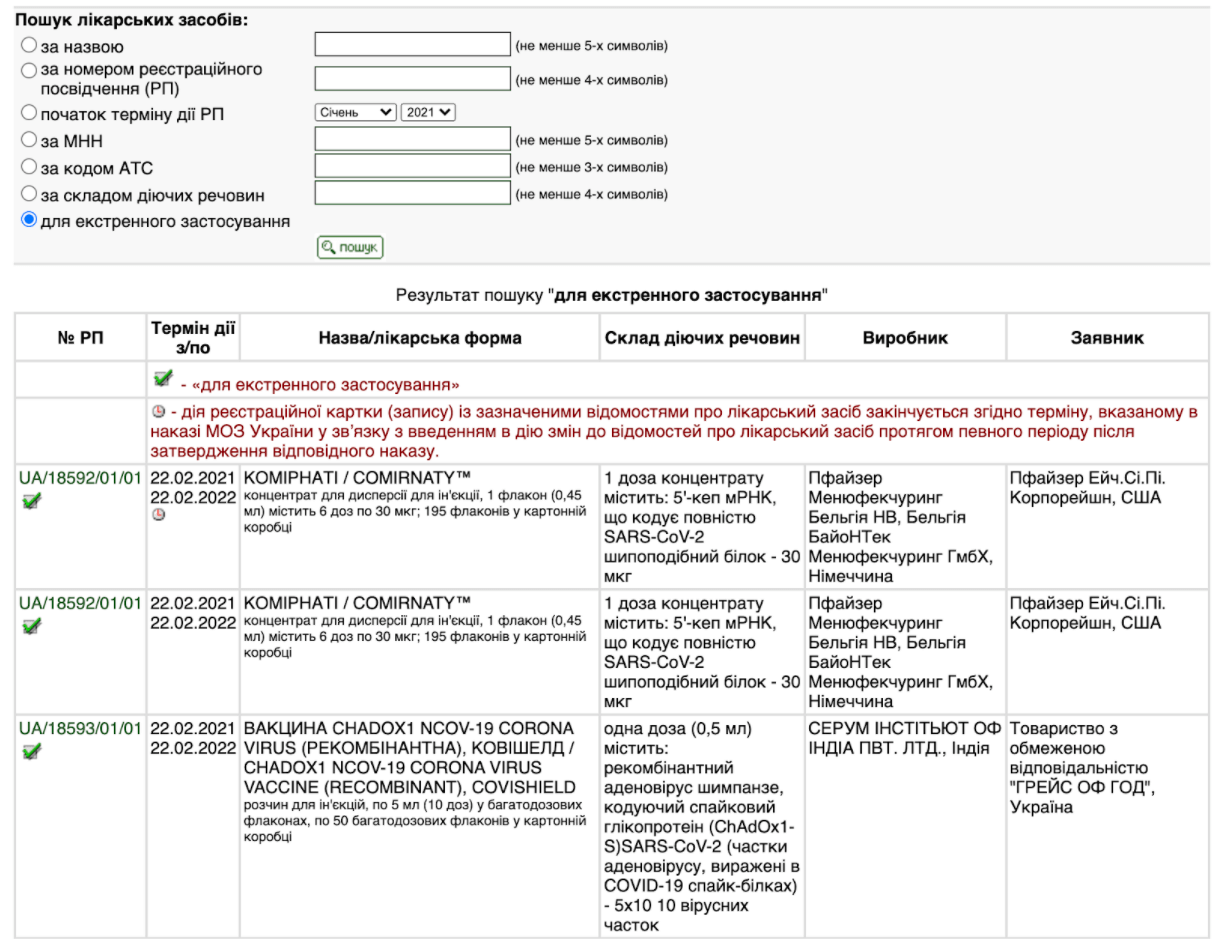
По-перше, вакцини і є імунобіологічними препаратами, тому вони так і зареєстровані. По-друге, всі вакцини, схвалені МОЗ, із відповідним посиланням на накази можна знайти на сайті Державного реєстру лікарських засобів, додавши фільтр «для екстреного застосування». Загальна назва «вакцини від COVID-19» не є торговельною назвою. Натомість торговельною назвою\маркою є Comirnaty, Covishield, Vaxzevria, Janssen, Coronavac — саме під такими назвами продають вакцини розробки Pfizer-BioNTech, Oxford-AstraZeneca, Sinovac Biotech, Johnson & Johnson.
Скриншот — Держреєстр лікарських засобів
Там також вказано склад діючих речовин кожної вакцини: аденовірус 26-го типу, що кодує спайковий глікопротеїн SARS-CoV-2, або інактивований SARS-CoV-2 антиген, або мРНК, що кодує повністю SARS-CoV-2 тощо.
По-третє, відповідно до постанови Кабінету Міністрів України № 95 від 08.02.2021, яка передбачає реєстрацію вакцин для профілактики COVID-19 під зобов’язання для екстреного медичного застосування, вакцини виробника Pfizer (Cominarity), Johnson & Johnson (Janssen), Oxford/AstraZeneca (Covishield, AstraZeneca), Sinovac Biotech (CoronaVac) зареєстровані в Україні та мають статус вакцини. Тільки вакцина виробника Moderna (Spikevax) не була зареєстрована на території України, вона була отримана у рамках міжнародної ініціативи COVAX.
Хибна теза: За «золотим стандартом» клінічних випробувань потрібно щонайменше 5 років для розробки безпечної вакцини. Зараз йде лише 4 стадія клінічного експерименту.
Золотим стандартом клінічних випробувань є рандомізоване подвійне сліпе дослідження з використанням групи плацебо-контроля, а не термін, за який лікарський препарат проходить 4 етапи клінічного випробування. Різним препаратам потрібен різний термін для проходження всіх стадій.
Вакцині, безумовно, важливо пройти всі етапи дослідження. Але четвертий етап клінічних випробувань якраз і відбувається вже після реєстрації препарату. Усі вакцини, які використовують в Україні, перебувають на третьому етапі клінічних випробувань.
Процес розробки, проведення різних етапів клінічних досліджень, затвердження вакцин може тривати від 10 до 15 років. У випадку з вакциною проти COVID-19 процес тривав 11 місяців.
Вакцини від COVID-19 були так швидко затверджені для екстреного застосування у зв’язку з багатьма факторами. По-перше, SARS-CoV-2 – не перший вірус в історії з сімейства коронавірусів та у вчених уже були певні попередні доробки. По-друге, уряди країн світу виділили великі кошти на розробку цих вакцин. По-третє, вчені зі всього світу співпрацювали.
Вакцини, якими проводять щеплення в Україні, пройшли етапи клінічних випробувань, які доводять безпечність та ефективність.
Компанії Pfizer та BioNTech (США та Німеччина) у проміжному звіті третього етапу випробувань заявили про 90% ефективність. У цьому етапі клінічних випробувань взяли участь понад 40 тис. волонтерів. У листопаді 2020 року Moderna у проміжному звіті третього етапу заявила про 95% ефективність своєї вакцини, у цьому етапі взяли участь понад 30 тис. волонтерів.
Проміжні результати випробувань AstraZeneca показали, що вакцина на 79% ефективна в запобіганні симптоматичному перебігу COVID-19 та на 100% захищає від важкого перебігу хвороби та госпіталізації. Проміжні результати третьої фази випробувань вакцини CoronaVac опублікували в липні 2021 року. Вони показали, що CoronaVac забезпечує 83,5% захист від симптоматичного COVID-19.
Хибна теза: Те, що вакцинація — це «клінічний експеримент», доводить наказ МОЗ №1775
Наказ МОЗ України від 20.08.2021 №1775, на який посилається авторка, немає нічого спільного з вакцинацією, оскільки у ньому йдеться про випробування препарату «PF-07321332/ритонавір». Авторка маніпулює назвою компанії — «Пфайзер Інк.», яка виготовляє вакцину Comirnaty й окремо розробляє новий таблетований препарат, про який якраз йдеться в наказі №1775. До того ж це не може бути масовою вакцинацією, бо випробування таблеток проходило всього у 8 українських лікарнях.
На початку листопада у Pfizer повідомили, що за результатами клінічного випробування ритонавір знижує ризик госпіталізації або смерті на 86% у порівнянні з плацебо у негоспіталізованих дорослих із високим ризиком захворіти на COVID-19. Якщо ж подальші результати подальших клінічних випробувань будуть успішними та препарат зареєструють у США чи ЄС, Україна буде закупляти ритонавір. На брифінгу 16 грудня Віктор Ляшко повідомив, що Україна підписала договір з компанією Pfizer на закупівлю препарату “Паксловід” — саме під цією назвою продають ритонавір.
Крім цього, авторка стверджує, що так званий «експеримент» запланували Законом України 2362-VIII “Про внесення змін до деяких законів України щодо повноважень в галузі охорони навколишнього природного середовища”. Цей фейк ми вже спростовували раніше.
У мережі також поширюють два скриншоти, які нібито доводять проведення в Україні «клінічного експерименту». На ці ж документи посилаються у згаданому відео.
Скриншоти з дописів у Facebook
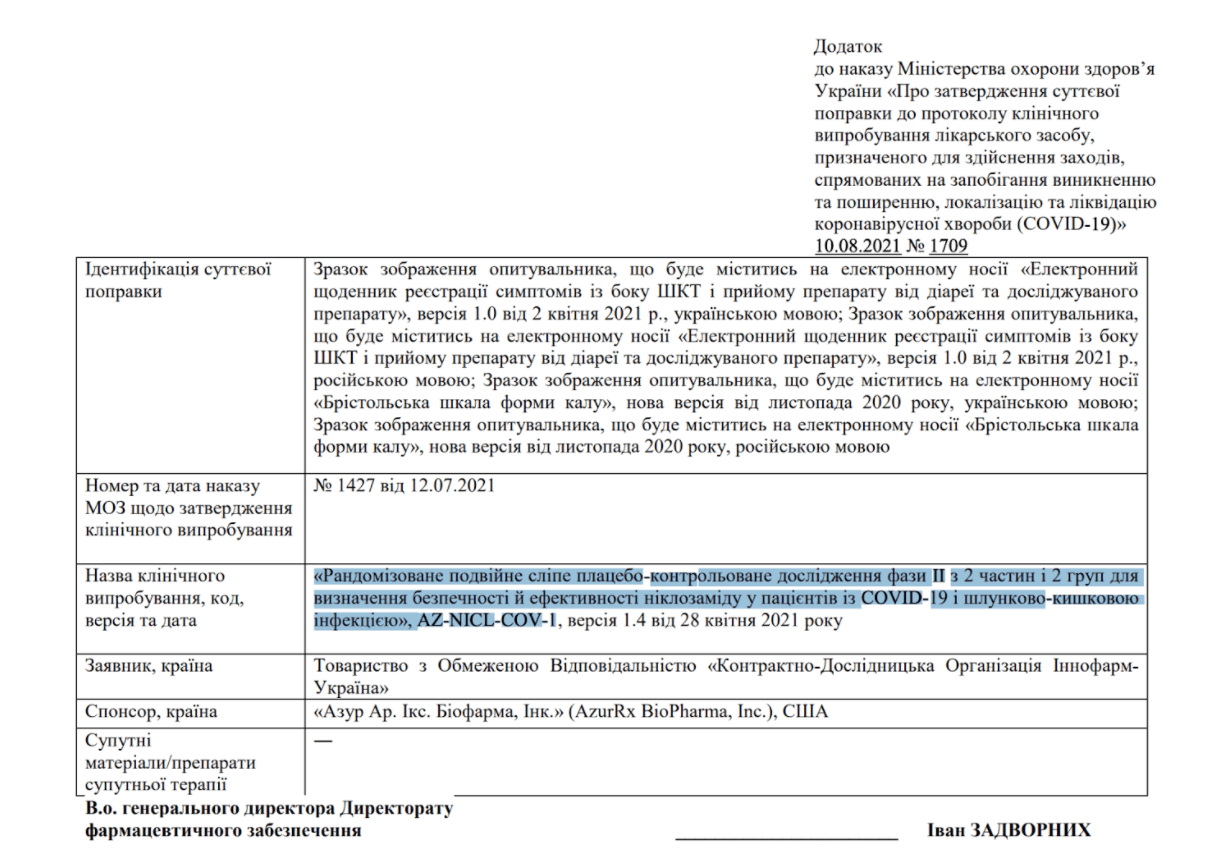
Однак у згаданих наказах не йдеться про «клінічний експеримент», а про клінічні випробування окремих препаратів — навіть не вакцин від COVID-19. Наприклад, у додатку до наказу №1709 вказано, що випробовуватимуть препарат ніклозамід у пацієнтів із COVID-19 і шлунково-кишковою інфекцією.
Додаток до наказу МОЗ України №1709
У наказі №1553 взагалі йдеться про випробування терапії для пацієнтів з раком легенів, а не вакцини чи ліки від COVID-19.
Додаток до наказу МОЗ України №1553
Застереження
Автори не є співробітниками, не консультують, не володіють акціями та не отримують фінансування від жодної компанії чи організації, яка б мала користь від цієї статті, а також жодним чином з ними не пов’язаний