Коронавірусна хвороба (COVID-19) швидко та широко розповсюдилася в більшості країн світу, що призвело до значної смертності в Європі та США, а також у численних країнах Південної Америки та Азії з рівнем доходів вище середнього. Експерти прогнозували мільйони смертей від COVID-19 в Африці тому, що багато країн континенту посідають низькі місця в Індексі людського розвитку Програми розвитку ООН.
Цю статтю було вперше опубліковано Science 7 серпня 2020 року за посиланням. Переклад на українську мову – VoxUkraine. Перепублікацію повної версії тексту заборонено.
Однак більш ніж через чотири місяці після виявлення перших випадків захворювання в Африці його поширеність та смертність від нього залишаються на низькому рівні. Все ще неясно, чи справді Африку обійшли стороною висока захворюваність та смертність. Однак відмінності між Африкою та найбільш постраждалими країнами у достовірності повідомлень та фіксації випадків смертності, суворості локдауну, демографії, соціокультурних аспектів, екології, генетики та імунної системи можуть допомогти пояснити ситуацію з COVID-19 в Африці.
Серйозні виклики в охороні здоров’я та соціально-економічній сфері, з якими стикається Африка, мали б сприяти швидкому поширенню COVID-19. Серед них слабка система охорони здоров’я (витрати на охорону здоров’я на душу населення становлять <50 дол. США у більшості країн Західної Африки порівняно з >2500 дол. США в Європі та Сполучених Штатах), скупченість населення, бідність та негігієнічні умови життя (1). Щільність населення є дуже високою в більшості столиць Африки, таких як Дакар (12 617 осіб / км²), Абіджан (11 155 осіб / км²) або Лагос (13 909 осіб / км²), тоді як у Нью-Йорку вона становить 7101 особу / км². Попри те, що повідомлення про поширення вірусу в громадах багатьох великих африканських міст надходили декілька місяців тому, прогнозованої кількості випадків смертності ще не спостерігалося (див. Рисунок). Мала кількість випадків захворювання часто пояснюється недостатнім тестуванням. Однак багато африканських країн розгорнули системи тестування дуже швидко. І, згідно з базою даних “Наш світ у даних” (OWID)(2), ними було проведено більше тестів на кількість випадків захворювань, ніж в інших країнах на подібних фазах епідемії (див. Рисунок). Щодо кількості смертей, на континенті діє небагато служб реєстрації актів цивільного стану і, отже, існує мало статистичних даних, що ставить під сумнів надійність даних про смертність. Потенційне заниження кількості смертей, пов’язаних із COVID-19, не є характерним лише для Африки, але тут похибка може бути вищою. До сьогодні африканські країни не повідомляли про гострі випадки проблем зі здоров’ям, однак Африці потрібно мати надійні дані з розбивкою за віком для повного розуміння ситуації з COVID-19 та уможливлення відповідних заходів.
Такі заходи як обмеження подорожей, заборона авіасполучення та закриття шкіл в Африці запровадили рано порівняно з іншими континентами – часто ще до того, як якась африканська країна виявляла випадок захворювання (рис. S1). Можливо в результаті такого раннього реагування зменшилася кількість привнесених ззовні випадків інфікування та інфікованість всередині країн, що дало їм досить часу, щоб підготувати свої не надто розвинені системи охорони здоров’я до діагностики та розробки карантинних стратегій, відстеження контактів та соціального дистанціювання на континенті, який уже мав подібний досвід контролю епідемій, таких як гарячка Ласса та Ебола. Хоча запровадження раннього локдауну в Африці, ймовірно, сприяло повільному поширенню інфекції, у багатьох країнах не дотримуються обмежувальних заходів повною мірою. Більшість людей працює в неформальному секторі бізнесу, наприклад, на традиційних ринках, що унеможливлює суворі заходи локдауну. Нещодавно на деякі африканські уряди чинився тиск щодо пом’якшення карантинних заходів, наприклад, задля проведення спільних молитов у мечетях Сенегалу. Досі невідомо, чи призведе пом’якшення стримуючих заходів до збільшення кількості випадків захворюваності, чи на це більше вплинуть інші чинники.
Більшість смертей, пов’язаних із COVID-19, – це люди похилого віку. Африка має порівняно молоде населення з середнім віком 19,7 років проти 38,6 років для США. Молодість населення Африки видно за віковою розбивкою випадків хвороби (рис. S2). Виходячи із загальносвітових показників смертності від COVID-19 та вікової демографічної ситуації в Африці, смертність від COVID-19 мала би бути лише в чотири (3), а не в спостережуваних 40 разів, нижча, ніж у Європі чи Сполучених Штатах. Однак наразі відсутні зведені дані для цього континенту щодо кількості випадків захворювання чи смертей у розрізі вікових груп. В Африці спостерігається значне змішування поколінь. І через більшу кількість випадків позаклінічних інфекцій у молодих людей, мабуть, лише питання часу, коли буде зафіксовано велику кількість випадків захворювання та смертей. З іншого боку, швидший розвиток стадного імунітету серед молодого населення може привести до меншої кількості тяжких випадків. Дані тестів на антитіла (серо-епідеміологічне обстеження) повинні пояснити, чи було інфікування з високим рівнем безсимптомних та легких випадків захворювання в африканських країнах більш поширеним, ніж в інших країнах.
Генетичні характеристики коронавірусу тяжкого гострого респіраторного синдрому (SARS-CoV-2) та генетика людини можуть бути одними з причин низького рівня захворюваності на тяжкий COVID-19 в Африці. Хоча внесок Африки в генетичну базу даних SARS-CoV-2 GISAID (Глобальна ініціатива щодо обміну всіма даними про грип) є відносно невеликим, виявлені в Африці ізоляти є репрезентативними для різних клад (генетичних груп) SARS-CoV-2, виявлених на інших континентах (рис. S3). Так, малоймовірно, що штами SARS-CoV-2 в Африці мають нижчу вірулентність. Ба більше, афроамериканці несуть непропорційно більший тягар смертності в США, тому здається малоймовірним, що нижча смертність від COVID-19 в Африці зумовлена генетичними факторами. Однак, консорціум COVID Human Genetic Effort має на меті з’ясувати, чи може генетика відігравати роль у моделях розвитку захворювання в усьому світі.
Інфікування SARS-CoV-2 призводить до неоднорідного результату. Близько 80% симптоматичних випадків мають легкий та середній ступінь, тоді як у близько 20% можуть бути важкі респіраторні захворювання та висока смертність (4). Розвиток ефективної адаптивної імунної відповіді може обмежити вірусну інфекцію, тоді як неконтрольована активація вроджених імунних клітин призводить до «цитокінового шторму» та гіперзапалення в легенях, що врешті веде до гострого респіраторного дистрес-синдрому (ГРДС) та поліорганної недостатності (4, 5). Можливість стримати вірусну інфекцію на ранній стадії або загальмувати надмірну запальну реакцію, ймовірно, є взаємодоповнюючими механізмами запобігання важкому перебігу хвороби.
У більшості симптомних хворих на COVID-19, що одужують, розвиваються специфічні до вірусу нейтралізуючі антитіла, а також специфічні відповіді CD4+ і CD8++ Т-клітин (5). Ефективність та адекватність цих адаптивних відповідей очищення від вірусних інфекцій залежать від багатьох чинників, у тому числі попередніх або одночасної інфікованості іншими патогенами. Наприклад, антитіла, спрямовані на чотири типи коронавірусу людини, що викликають «простудні захворювання», можуть реагувати перехресно та нейтралізувати SARS-CoV-2 у людини (6), а вже існуючі перехресно-реактивні Т-клітини можуть бути виявлені в осіб, яких не вражав SARS-CoV-2 (7), що свідчить про те, що ураження в минулому відповідними людськими коронавірусами може генерувати імунологічну перехресну реактивність (7).
Існують значні відмінності у впливі навколишнього середовища між Африкою та Європою і США. Неінфекційні захворювання (НІЗ), такі як серцево-судинні захворювання, ожиріння та діабет 2-го типу, є факторами ризику розвитку тяжкого перебігу COVID-19. Ці стани, що виникають внаслідок екологічних та поведінкових чинників, усе частіше з’являються в головних містах Африки – більшість випадків смертності від COVID-19 в Африці трапляються серед людей похилого віку з НІЗ. На континенті розповсюджені такі інфекційні захворювання як ВІЛ, туберкульоз, малярія та інші респіраторні інфекції, або хвороби, викликані гельмінтами (паразитичними глистами), проте наразі є мало інформації щодо того, яким чином і чи впливають ці інфекції на розвиток COVID-19 .
Розподіл COVID-19 та випадки захворювання відносно тестування
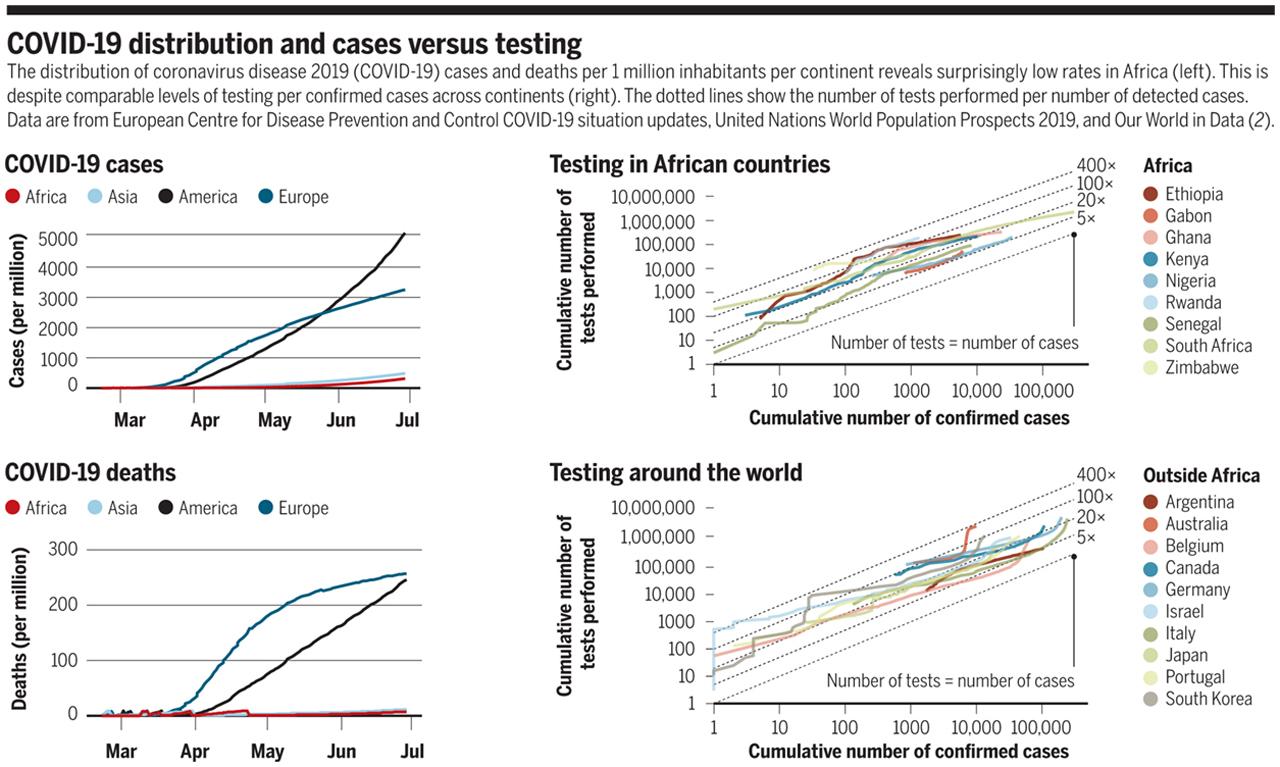
Розподіл випадків захворюваності та смертності від коронавірусної хвороби (COVID-19) на 1 мільйон жителів за континентами виявляє напрочуд низькі показники в Африці (зліва) незважаючи на порівнянні рівні тестування на підтверджені випадки на всіх континентах (праворуч). Пунктирними лініями показано кількість проведених тестів на кількість виявлених випадків. Дані отримані з Європейського центру з профілактики та контролю захворювань, звіту ООН “Перспективи світового народонаселення” (2019 рік) та наукового онлайн видання “Наш світ у даних” (OWID) (2).
Все більше визнається той факт, що імунна система формується не лише генетикою, а й чинниками зовнішнього середовища, такими як вплив мікроорганізмів та паразитів. Це навчає імунну систему виробляти захист від вторгнення патогенних мікроорганізмів не лише специфічно, але й неспецифічно, наприклад, за допомогою «тренованого імунітету», що передбачає перепрограмування вроджених клітин, які можуть демонструвати потужнішу реакцію на патоген у випадку повторного зіткнення з ним (8), чи “віртуальної пам’яті”. (9). Т-клітини віртуальної пам’яті (TVM-клітини) поширюються у відповідь на цитокіни, такі як індукований гельмінтами інтерлейкін-4 (IL-4), а не через специфічні для патогенів антигени, що призводить до посилення противірусних ефекторних функцій (9). Так, можна передбачити, що TVM-клітини є більш поширеними серед жителів Африки внаслідок більшого впливу таких патогенів. Це може покращити контроль над SARS-CoV-2. Крім того, як постулює «гігієнічна гіпотеза», раннє та хронічне ураження патогенними мікроорганізмами, що призводить до невпинної активації імунних клітин у суворих умовах, індукує сильну регуляторну імунну відповідь для протидії надмірному запаленню (10).
Здатність запобігати надмірному запаленню може бути критично важливим параметром, пов’язаним із наслідками COVID-19. Останні дані свідчать про те, що кількість запальних альвеолярних макрофагів (АМ), що можуть виникати внаслідок диференціації рекрутованих моноцитів при зараженні, збільшується в легенях у пацієнтів з тяжким COVID-19 (11). Неясно, чи є ці АМ, отримані з моноцитів, важливим джерелом синдрому вивільнення цитокінів, який спостерігається під час зараження SARS-CoV-2, чи вони беруть участь у патогенезі ГРДС. Однак, як неодноразово спостерігалось, моноцитні та макрофагові запальні цитокіни, такі як IL-6, є маркером тяжкого перебігу COVID-19, і, таким чином, мієлоїдні клітини, ймовірно, пов’язані з гіперзапаленням. У осіб із Африки з високим впливом патогенів моноцити можуть бути менш прозапальними (12). Так, їхнє поповнення в легенях може запобігти значному виробництву цитокінів і, отже, привести до кращих результатів лікування COVID-19. Ба більше, мікробіота дихальних шляхів, а також більш дистальна мікробіота кишечника, можуть зіграти важливу роль у запобіганні або потенціації інфекцій дихальних шляхів та модуляції індукованого вірусом запалення, як було показано для деяких респіраторних вірусів (13). Таким чином, відомі варіації мікробіоти в усіх географічних районах також можуть брати участь у модуляції тяжкості захворювання, і їх необхідно вивчати.
Африка має бути частиною дорожньої карти досліджень COVID-19. Навіть за відсутності даних щодо імунної відповіді у пацієнтів з COVID-19 з Африки, дослідження показують чіткі відмінності в активації, запаленні та профілях пам’яті імунних клітин не лише між африканцями та європейцями, але й між африканцями, що зазнають високого та низького впливу мікроорганізмів та паразитів (14) (рис. S4). Чи має значення різниця в імунологічних профілях для наслідків COVID-19 в Африці? Це питання потребує подальших досліджень. Водночас моделі розвитку COVID-19 у міській та сільській місцевості Африки можуть бути інформативними.
Існують розбіжності в думках щодо того, чи відрізняється характер розповсюдження SARS-CoV-2 в Африці від того, що спостерігається в США та Європі. Незважаючи на нестачу даних, наразі виявляється, що вірус поширюється по-різному, з потенційно м’якшими наслідками в Африці. Тестування безсимптомних випадків або титрів антитіл було обмеженим. Тож невідомо, чи запобігти передачі інфекції вдалося завдяки ранньому реагуванню, чи існують відмінності у вразливості між населенням різних регіонів. Можливо, пандемія COVID-19 може наголосити на необхідності широкого впровадження таких інструментів охорони здоров’я як високоякісні дані, точна діагностика та відстеження, хороша комунікація та ефективна вакцина. Раннє тестування вакцин у різних регіонах Африки є надзвичайно важливим, оскільки високий ступінь відкритості до патогенних мікроорганізмів може дещо обмежити реакцію пацієнтів на вакцину (15). Перше тестування вакцини проти COVID-19 розпочинається в Південній Африці (Ox1Cov-19 Vaccine VIDA-Trial), а також планується проведення інших. Сподіваємось, це стимулюватиме повноцінну участь Африки в дослідженнях найважливіших чинників, що містять ключ до інноваційних рішень у боротьбі з пандемією.
Посилання та примітки
- M. Martinez-Alvarez et al., Lancet Glob. Health 8, 631 (2020).
- Our World in Data, Statistics and research: Coronavirus pandemic (COVID-19); https://ourworldindata.org/coronavirus.
- F. Mougeni et al., MedRxiv10.1101/2020.05.19.20106914 (2020).
- X. Cao, Nat. Rev. Immunol.20, 269 (2020).
- N. Vabret et al., Immunity 52, 910 (2020).
- K. Ng et al., bioRxiv10.1101/2020.05.14.095414 (2020).
- A. Grifoni et al., Cell181, 1489 (2020).
- R. J. W. Arts et al., Cell Host Microbe23, 89 (2018).
- M. Rolot et al., Nat. Commun. 9, 4516 (2018).
- M. Yazdanbakhsh, P. G. Kremsner, R. van Ree, Science296, 490 (2002).
- M. Liao et al., Nat. Med. 26, 842 (2020).
- K. K. Smolen et al., J. Immunol. 193, 3003 (2014).
- N. Li, W.-T. Ma, M. Pang, Q.-L. Fan, J.-L. Hua, Front . Immunol. 10, 1551 (2019).
- M. Mbow et al., Immunology143, 569 (2014).
- E. Muyanja et al., J. Clin. Invest. 124, 3147 (2014).


